(一) 实验目的、
1) 学习细胞传代知识
2) 掌握细胞传代
3) 进行细胞传代
(二) 方法与材料、
8 s# [& n3 i7 }5 d, R; u1. 所用细胞:卵巢癌细胞HO-8910 HO-8910PM 4 Y, z8 k/
2. 试剂:0.25%胰酶、1640培养基(含10%小牛血清) ) e1 C1
3. 仪器和器材:倒置显微镜,培养箱、培养瓶、吸管、废液缸等
(三) 步骤、
1. 吸除培养瓶内旧培养液。
2. 向瓶内加入胰蛋白酶和EDTA混合液少许,以能覆满瓶底为限。
3. 置温箱中2~5分钟,当发现细胞质回缩,细胞间隙增大后,立即终止消化。
4. 吸除消化液,向瓶内注入培养液数毫升,轻轻转动培养瓶,把残余消化液冲掉。注意加培养液冲洗细胞时,动作要轻,以免把已 松动的细胞冲掉流失。
5. 用吸管吸取营养液轻轻反复吹打瓶壁细胞,使之从瓶壁脱离形成细胞悬液。
6. 把细胞悬液吸取部分装入新培养瓶中,置温箱中培养。
细胞培养的一般过程
准备工作
准备工作的内容包括器皿的清洗、干燥与消毒,培养基与其他试剂的配制、分装及灭菌,无菌室或超净台的清洁与消毒,培养箱及其他仪器的检查与调试等;
取材;
在无菌环境下从机体取出某种组织细胞(视实验目的而定),经过一定的处理(如消化分散细胞、分离等)后接入培养器血中,这一过程称为取材。如是细胞株的扩大培养则无取材这一过程。机体取出的组织细胞的**培养称为原代培养。理论上讲各种动物和人体内的所有组织都可以用于培养,实际上幼体组织(尤其是胚胎组织)比成年个体的组织容易培养,分化程度低的组织比分化高的容易培养,肿瘤组织比正常组织容易培养。取材后应立即处理,尽快培养,因故不能马上培养时,可将组织块切成黄豆般大的小块,置4℃的培养液中保存。取组织时应严格保持无菌,同时也要避免接触其他的有害物质。取病理组织和皮肤及消化道上皮细胞时容易带菌,为减少污染可用抗菌素处理。
培养%
将取得的组织细胞接入培养瓶或培养板中的过程称为培养。如系组织块培养,则直接将组织块接入培养器皿底部,几个小时后组织块可贴牢在底部,再加入培养基。如系细胞培养,一般应在接入培养器皿之前进行细胞计数,按要求以一定的量(以每毫升细胞数表示)接入培养器皿并直接加入培养基。细胞进入培养器皿后,立即放入培养箱中,使细胞尽早进入生长状态。
正在培养中的细胞应每隔一定时间观察一次,观察的内容包括细胞是否生长良好,形态是否正常,有无污染,培养基的PH 是否太酸或太碱(由酚红指示剂指示),此外对培养温度和CO2 浓度也要定时检查。
一般原代培养进入培养后有一段潜伏期(数小时到数十天不等),在潜伏期细胞一般不分裂,但可贴壁和游走。过了潜伏期后细胞进入旺盛的分裂生长期。细胞长满瓶底后要进行传代培养,将一瓶中的细胞消化悬浮后分**两到三瓶继续培养。每传代一次称为“一代”。二倍体细胞一般只能传几十代,而转化细胞系或细胞株则可无限地传代下去。转化细胞可能具有恶性性质,也可能仅有不死性(Immortality)而无恶性。培养正在生长中的细胞是进行各种生物医学实验的良好材料。
冻存及复苏;
为了保存细胞,特别是不易获得的突变型细胞或细胞株,要将细胞冻存。冻存的温度一般用液氮的温度-196℃,将细胞收集**冻存管中加入含保护剂(一般为二甲亚砜或甘油)的培养基,以一定的冷却速度冻存,**终保存于液氮中。在极低的温度下,细胞保存的时间几乎是无限的。
复苏一般采用快融方法,即从液氮中取出冻存管后,立即放入37℃水中,使之在一分钟内迅速融解。然后将细胞转入培养器皿中进行培养。
冻存过程中保护剂的选用、细胞密度、降温速度及复苏时温度、融化速度等都对细胞活力有影响。
(四) 结果、
细胞传代培养照片如下:
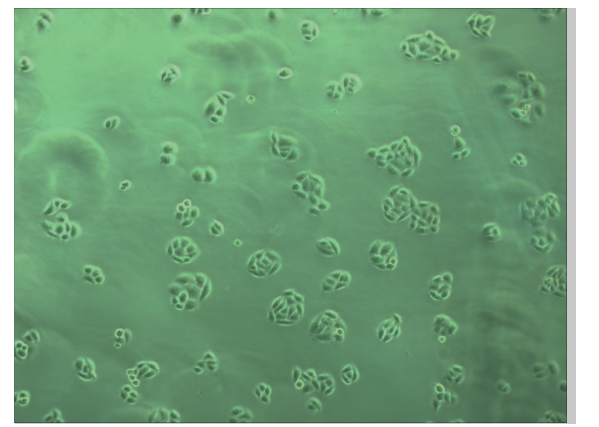
图 一:放大100倍下细胞照片

图 二 :放大200倍下细胞照片
(五) 总结
这次实验让我们熟悉了无菌操作和传代培养的方法和步骤,也熟悉了各种实验仪器的使用。**次作细胞实验,对各种方法和步骤都不熟悉,但是在老师的指导下**后实验基本成功,也看到了自己传代的癌细胞,还是欣慰的。